- 23 Novembre 2017Donato il materiale informatico per la Scuola di Ain Ebel, Libano
- 02 Agosto 2017Due parchi giochi a Camerino e Visso: Ŕ il dono di Fondazione Ginevra Caltagirone e Rock no war!
- 26 Luglio 2017Fondazione Ginevra Caltagirone al Gala di beneficenza 2017 in Accademia a Modena insieme a Rock no War!
- 11 Maggio 2017Partito il materiale informatico per la Scuola di Ain Ebel (Libano)
- 13 Aprile 2017Fondazione Ginevra Caltagirone grazie a Rock No War! prepara la donazione per la Scuola di Ain Ebel (Libano)
Si conclude con il 2016 l'attivitÓ di ricerca finanziato da Fondazione Ginevra Caltagirone sulle LAM pediatriche

l lavoro sulla evoluzione clonale della LAM è proseguito in questi ultimi mesi del 2016 cercando di descrivere in maniera quasi "grafica" il comportamento di questa malattia quando si ripresenta dopo la chemioterapia. I risultati del lavoro che descriveremo in seguito sono stati recentemente sottomessi alla rivista scientifica Oncotarget ed attualmente in revisione.
Il sequenziamento massivo dell'esoma delle condizioni di esordio, remissione e recidiva ha permesso di definire con precisione lo spettro di mutazioni presente all'esordio e confrontarlo con quello presente alla recidiva.
Un primo risultato è quindi stato la descrizione policlonale della LAM pediatrica, estendendo la validità del modello di evoluzione clonale della malattia, già convalidato per la LAM dell'adulto.
Un secondo risultato è stato la caratterizzazione di mutazioni presenti all'esordio o alla recidiva o in entrambi le fasi della malattia.
Tra questi si la mutazione A72V di PTPN11, che compare alla recidiva nel 64% della popolazione blastica, e la mutazione D835E di FLT3, associati ad aumento dei segnali proliferativi cellulari, ma anche mutazioni descritti per la prima volta nelle LAM pediatriche tra cui la mutazione di TYK2 e ASXL3.
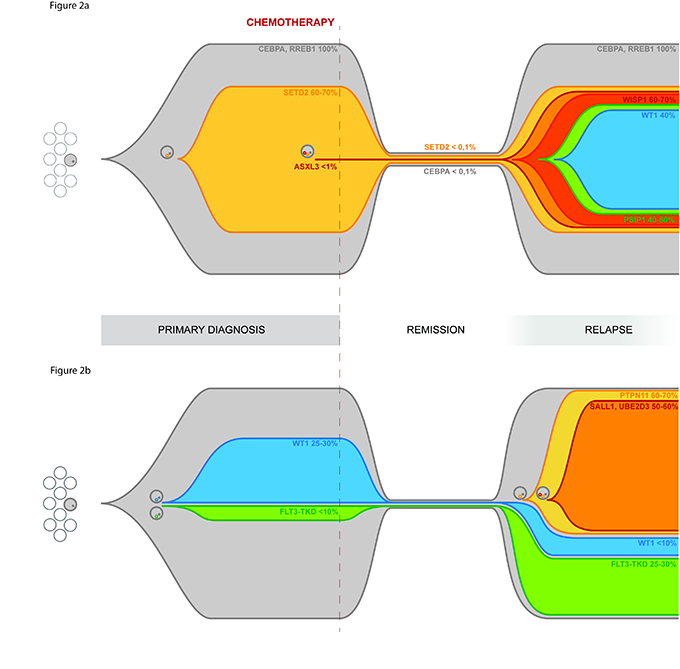
Avendo così definito lo spettro mutazionale dei pazienti studiati durante la seconda parte del progetto ci si è concentrati sul capire quali di queste mutazioni sia importante per lo sviluppo della recidiva e se le mutazioni presenti alla recidiva possano essere presenti in un piccola percentuale di clone già all'esordio.
In definitiva si può dire che molte di queste mutazioni sono potenziali target di terapie mirate, perciò l'accurata caratterizzazione molecolare della malattia, anche alla recidiva, offre la possibilità di adottare scelte terapeutiche mirate, eventualmente anche dirette simultaneamente verso subcloni diversi. Inoltre da questo lavoro emerge l'importanza del sequenziamento ad alta risoluzione come potenziale strumento in ambito diagnostico per rilevare mutazioni specifiche per cui esistono terapie target.
Durante il secondo quadrimestre l'attività si è concentrata a traslare i risultati visti sulle linee cellulari direttamente su blasti derivati da pazienti pediatrici affetti da Leucemia Acuta Mieloide (LAM) e positivi per il gene di fusione CBFA2T3-GLIS2. Al momento i risultati definitivi riguardano solo un paziente risultato positivo al gene di fusione. I blasti di questo paziente insieme a dei blasti di pazienti LAM negativi per lo steso gene di fusione sono stati trattati con dosi scalari di GANT61 per 72 ore ed è stata così ricavata l'IC50 (dose letale per il 50% delle cellule).
Dall'analisi dei dati si è chiaramente visto che blasti positivi per la fusione di GLIS2 sono più sensibili al trattamento rispetto ai blasti negativi per la stessa fusione. Questo dato conferma quanto già visto nelle linee cellulari e suggerisce con molta probabilità la specificità del farmaco nell'inibire il gene di fusione.
Questi dati sono di estremo interesse perché potrebbero aprire nuove possibilità terapeutiche combinate con altri farmaci target o in associazione con i chemioterapici convenzionali. Siamo ora in attesa dei commenti dei revisori della rivista Oncotarget e speriamo che questa ricerca, che ha impegnato per questi anni il Dott. Riccardo Masetti ed il suo staff, possa aprire la strada all'inserimento di nuovo farmaco destinato alla cura delle Leucemie Mieloidi Acute in età pediatrica.

